Ca2+ + Cl− + Ag+ + NO3− → AgCl↓ + Ca2+ + NO3−
Рассуждаем так: раствор образуется из нейтральных веществ, значит, до и после реакции его общий заряд должен быть равен нулю (в замкнутой системе при любых процессах алгебраическая сумма электрических зарядов остаётся неизменной). Если в левой части уравнения перед ионом хлора не поставить коэффициент 2, то согласно уравнению раствор до реакции будет иметь положительный заряд. Из тех же соображений следует поставить коэффициент 2 перед ионом NO3− в правой части уравнения. Согласно закону сохранения массы вещества следует поставить коэффициенты перед ионом Ag+ и молекулой AgCl:
Ca2+ + 2 Cl− + 2 Ag+ + 2 NO3− = Ca2+ + 2 NO3− + 2AgCl↓
Окислительно-восстановительные реакции во время электролиза также происходят с учётом законов сохранения электрического заряда и массы вещества. С помощью этих за-конов можно объяснить формулу закона Фарадея 𝑚 = 1/𝐹 · 𝑀/𝑛 · 𝑞, где 𝑞 — заряд, прошедший через раствор, 𝑀 — молярная масса вещества, 𝑛 — валентность атома, 𝐹 — постоянная Фарадея.
Согласно закону сохранения электрического заряда через электролитическую ванну за время 𝑡 прошёл такой же заряд, как и через провод, соединяющий её с источником тока, поэтому заряд можно определить по формуле 𝑞 = 𝐼 · 𝑡, измерив силу тока амперметром. Постоянную Фарадея можно выразить следующим образом: 𝐹 =𝑞𝑛 · 𝑁𝐴/𝑛, где 𝑞𝑛 — заряд иона, 𝑁𝐴 — постоянная Авогадро, 𝑛 — валентность элемента.
Подставив постоянную Фарадея в формулу закона Фарадея, получим:
𝑚 = 𝑀 / (𝑞𝑛 · 𝑁𝐴/𝑛 · 𝑛); 𝑚 = (𝑀/𝑁𝐴) · (𝑞/𝑞𝑛)
Здесь 𝑀/𝑁𝐴 — масса одного атома, 𝑞/𝑞𝑛 — число ионов, прошедших через раствор электролита за время электролиза и превратившихся на электродах в нейтральные атомы.
Таким образом, масса вещества, которое выделяется на одном из электродов при электролизе, определяется числом ионов, прошедших через электролит, и равна массе атомов, выделяющихся на электроде. При рассуждениях мы исходили из законов сохранения электрического заряда и массы вещества: заряд каждого иона при прохождении тока через раствор электролита остался неизменным и масса атомов при различных реакциях, которые происходят в растворах электролитов, также не меняется.

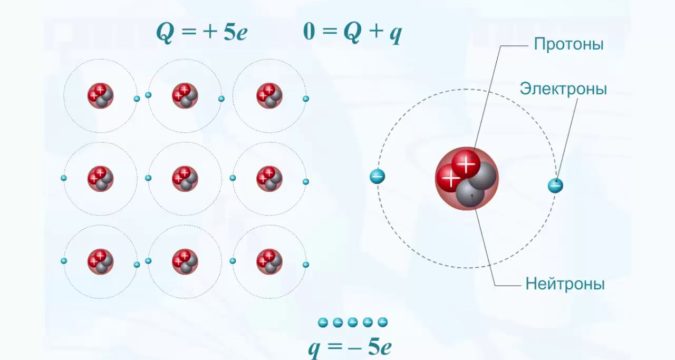
Рассмотрим более подробно процессы, которые происходят во время электролиза, например, расплава поваренной соли (рис. 24). При диссоциации хлорида натрия NaCl образуются ионы, общий заряд которых равен нулю:
NaCl → Na+ + Cl−
Ионы хлора перемещаются к положительному электроду, где, «отдав» по одному электрону, окисляются, образуя нейтральные атомы, соединяющиеся в молекулы:
Cl− − 1𝑒̅ = Cl0; Cl0 + Cl0=Cl2↑ (2 Cl− − 2𝑒̅ → Cl20↑)
Ионы натрия перемещаются к отрицательному электроду и, получив от него по одному электрону, восстанавливаются до нейтральных атомов:
Na+ + 𝑒̅ → Na0
Число электронов, которые перешли на анод от ионов хлора, равно числу электронов, которые забрали ионы натрия от катода. Из нейтрального вещества снова образовались нейтральные вещества.
Почему надо чистить зубы? Зубы покрыты эмалью — самой твёрдой тканью человеческого тела; по твёрдости она приближается к кварцу. На 93% эмаль состоит из неорганического вещества апатита Ca5(PO4)3OH. В кристаллическую решётку этого вещества могут проникать посторонние ионы, оно не кислотоупорно. И хотя мы не употребляем с пищей сильных кислот, но если не выполнять правила гигиены ротовой полости, на зубах появляется кислота, которая и разъедает эмаль. Кислота вырабатывается микроорганизмами, для них ротовая полость — «настоящий рай». Здесь тепло, влажно и много пищи. На неухоженных зубах появляются бактериальные наросты — кариозные бляшки. Они и начинают свою разрушительную работу. Микроорганизмы составляют более половины зубного налёта, в одном его грамме находится около 300 млрд. живых существ — бактерий, микроскопических грибков, амёб. Под действием бактерий сахар, попадающий в ротовую полость, сбраживается и превращается в кислоту, после чего начинается разрушение зуба.
Ионы водорода, которые появляются в слюне вследствие диссоциации кислот, вытесняют из молекулы апатита ионы кальция, в результате чего эмаль растворяется:
Ca5(PO4)3OH + H+ → Ca2+ + HPO42− + H2O
Чтобы увидеть, каково соотношение между разрушающей кислотой и эмалью, следует в этом уравнении расставить коэффициенты. Учитываем, что при любых перераспределениях ионов в замкнутой системе алгебраическая сумма зарядов должна оставаться постоянной. Знак равенства в уравнении можно поставить в том случае, если заряд ионов водо-рода, заместивших ионы кальция в Ca5(PO4)3OH, будет равен алгебраической сумме зарядов ионов Ca2+ и HPO42−, образовавшихся после реакции:
Ca5(PO4)3OH + 4H+ = 5Ca2+ + 3HPO42− + H2O;
+4 = (+10) + (−6); +4 = +4
Алгебраическая сумма электрических зарядов в растворе, окружающем зуб, до и после реакции остаётся одной и той же: в нём уменьшилось число ионов водорода, но увеличилось число ионов кальция. С точки зрения закона сохранения электрического заряда всё осталось по-прежнему, но с точки зрения человека, страдающего кариесом, произошли существенные изменения: ведь кислота, содержащаяся в слюне, частично растворила эмаль (соотношение 4:1): на зубе появились белые пятнышки. Но не всё ещё потеряно: если бляшки регулярно удалять зубной щёткой и не «кормить» бактерии сладостями, вымытые из эмали ионы кальция Ca2+ и HPO42− снова будут проникать в кристаллическую решётку эмали зуба:
Ca2+ + HPO42− + H2O → Ca5(PO4)3OH + H+
Если бляшки не удалять, то бактерии проникнут под эмаль, где находится дентин — менее твёрдое вещество, чем эмаль, и менее сопротивляющееся действию кислот.
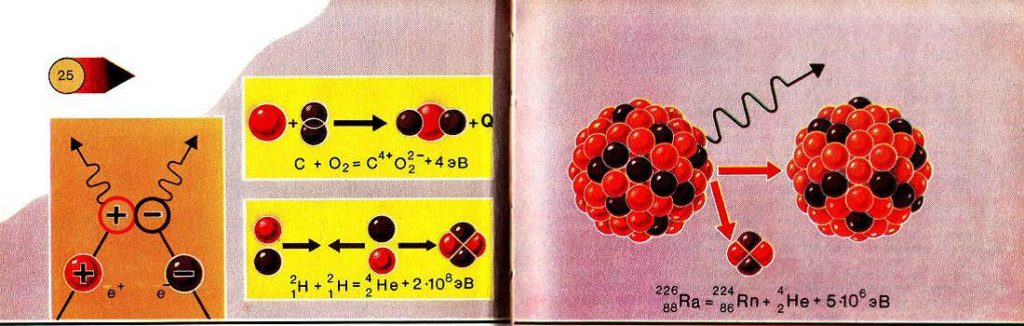
Можно сказать, что все превращения в микромире происходят с учётом закона сохранения электрического заряда (рис. 25). Известный учёный Альберт Сент-Дьёрдьи, автор книг «Биоэнергетика» и «Биоэлектроника», говорит, что удивительно тонкие биохимические реакции, по всей вероятности, представляют собой реакции очень мелких, лабильных частиц, каковыми являются электроны. Вспомните хотя бы реакции фотосинтеза. Посмотрите, сколько вокруг зелени, сколько электронов покидают молекулы хлорофилла в этот миг, получив квант света! Что было бы, если бы некоторые из них «потерялись»? Молекулы хлорофилла выключились бы из «работы». Но такого не случается, так как действует закон сохранения электрического заряда. Молекула хлорофилла, потеряв электрон, приобретает положительный электрический заряд, иначе говоря, в ней есть место для электрона, называемое в физике дыркой. Долго оно не остаётся вакантным. Его занимает электрон иона гидроксила, образовавшегося при диссоциации молекулы воды, и молекула хлорофилла снова готова принять следующий квант. Покинувший её электрон и ион водорода, образовавшийся вместе с ионом гидроксила при диссоциации молекулы воды, попадают в ферментную систему, где происходят реакции фотосинтеза. Ни один электрический заряд из бесчисленного множества участвующих в биохимических реакциях зарядов не пропадает.
Вот у кого учиться бережливости — у природы…
И снова умрёшь, и появишься снова,
Год ли спустя, миллион ли годов —
Частный случай на вечной основе,
Который мгновенно возникнуть готов.
Да, я родился, проживу до ста,
Чтобы затем навсегда умереть.
Но я — электронов случайная доза,
А эта случайность возможна и впредь.
И. Сельвинский