
Допустим, нам нужно подобрать металл для катодного покрытия, т. е. с возможно меньшей работой выхода электронов. Обратившись к периодической системе элементов, мы придём к выводу, что такой металл следует искать среди веществ, образованных атомами элементов первой группы главной подгруппы, особенно в нижней части таблицы: атомы расположенных там элементов отличаются тем, что в них со стороны ядра на валентные электроны действует сила, значительно меньшая, чем в атомах других элементов. Это обусловлено тем, что атомы элементов, расположенных в нижней части таблицы, имеют много энергетических уровней, и следовательно, валентные электроны находятся сравнительно далеко от ядра. В атомах первой группы на них действует наименьший заряд ядра +1 (его мы будем называть «эффективным»), остальной заряд ядра как бы «нейтрализуется» внутренними по отношению к валентным электронами. У атомов второй группы «эффективный» заряд равен +2, третьей — +3 и т. д.
Выбрать вещества с высокой или низкой температурой плавления также поможет периодическая таблица. Каждый период в периодической системе элементов начинается щелочным металлом, в кристаллической решётке которого положительные ионы «сцементированы» свободными электронами. Такие кристаллы имеют невысокую температуру плавления. Атомы следующего в периоде элемента имеют больший эффективный заряд ядра, но меньший радиус атома, что способствует увеличению прочности связи между атомами и повышению температуры плавления. С атомов третьего в периоде элемента начинается заполнение p-подуровня электронной оболочки: дополнительно к металлическим связям, обусловленным s-электронами, появляются ковалентные связи, обусловливающие бóльшую прочность кристаллической решётки и повышение температуры плавления; наиболее высокую температуру плавления имеют кристаллы веществ, состоящие из атомов элементов, расположенных в средней части периода. К концу периода число валентных электронов у атомов элементов увеличивается, увеличивается прочность связи между двумя атомами, образующими молекулу, но уменьшается прочность связи между молекулами, образующими кристалл. Связи между частицами кристалла в периоде изменяются от металлических через ковалентные к молекулярным. Соответственно изменяется и температура плавления кристаллов. Подтвердим наши рассуждения примером: покажем, как изменяется температура плавления кристаллов, состоящих из атомов элементов III периода:
Na Mg Al Si P S
97,8 °C 650 °C 660,1 °C 1420 °C 580 °C 112,8 °C
Из примера видно, что самая высокая температура плавления у кристаллов кремния — элемента, расположенного в средней части таблицы, что соответствует нашим выводам.
Таблица Менделеева указывает путь, как получить вещества с заданными свойствами. Она помогла, например, при «проектировании» боразона — вещества, подобного алмазу. Кристаллическая решётка этого вещества состоит из атомов азота и бора — соседей углерода в периодической таблице. Как и в кристаллической решётке алмаза, в решётке боразона на каждые два иона приходится восемь валентных электронов, образующих ковалентные связи: по твёрдости и прочности боразон не уступает алмазу.
Аналогично получен полупроводник арсенид галлия. Его кристаллы состоят из атомов элементов, которые являются соседями германия в периодической таблице. Кристаллическая решётка арсенида галлия подобна решётке германия, поэтому свойства этих веществ похожи.
Квантовые числа. Каждый восьмиклассник знает, в чём состоит суть периодического закона: «Свойства химических элементов находятся в периодической зависимости от заряда атомных ядер». Д. И. Менделеев открытый им закон сформулировал несколько иначе: «Элементы, расположенные по величинам их атомного веса, представляют явственную периодичность свойств». В основу классификации элементов Менделеев положил массу атомов. Периодический закон был открыт в 1869 г. В то время строение атомов не было известно, поэтому Менделеев не мог объяснить периодичность свойств элементов. Сейчас периодическую систему элементов можем построить даже мы с вами, но для этого нужно знать квантовые числа, определяющие состояние каждого электрона в атоме. Вспомним слова Пифагора о том, что понявший тайну целых чисел узнает тайны мироздания, и наберёмся терпения, чтобы понять, как заселяются электронами оболочки атома. Для этого прежде всего выясним, что представляют собой квантовые числа. С главным квантовым числом 𝑛 вы встречались на страницах учебника физики в X классе. Оно определяет энергетический уровень или номер оболочки атома, на которой находится электрон. Каждому главному квантовому числу отвечает и соответствующая оболочка:
1, 2, 3, 4, 5, 6, 7…
𝐾, 𝐿, 𝑀, 𝑁, 𝑂, 𝑃, 𝑄…
Второе квантовое число 𝑙 называют орбитальным или побочным, оно подчёркивает «неравноценность» всех электронов в данной оболочке. В связи с этим электронные оболочки (кроме K-оболочки) подразделяются на подоболочки, каждая из которых характеризуется определённым значением орбитального квантового числа (оно всегда меньше 𝑛 и принимает целочисленные значения: 0, 1, 2, 3,…, 𝑛−1). Подоболочки также обозначают буквами в соответствии со значением числа 𝑙:
0, 1, 2, 3, 4…
𝑠, 𝑝, 𝑑, 𝑓, 𝑔 …
Электроны, которые находятся на той или иной подоболочке, называются в соответствии с её обозначением: s-электронами, p-электронами и т. д.
Чтобы определить число электронов, вмещаемых той или иной подоболочкой, надо знать ещё магнитное квантовое число 𝑚 и спин электрона 𝑚𝑠. Для данного квантового числа 𝑙 магнитное квантовое число 𝑚 принимает значения: 0, ±1, ±2, …, ±𝑙, т. е. 2𝑙+1 значение. И наконец, в состоянии, определяемом тремя квантовыми числами 𝑛, 𝑙, 𝑚, может быть только два электрона с противоположными спинами (𝑚𝑠 = 1/2 и 𝑚𝑠 = −1/2).
Подсчитаем, сколько электронов может быть на той или иной подоболочке. Из курса химии известно, что на второй оболочке (на втором энергетическом уровне) может быть восемь электронов. Проверим, получится ли это число, если мы при подсчётах используем знания о квантовых числах. Электроны на втором энергетическом уровне характеризуются главным квантовым числом 𝑛 = 2; орбитальное число 𝑙 может принимать два значения: 0 и 1; магнитное квантовое число 𝑚 может принимать три значения: 0, ±1.
Таким образом, каждому возможному состоянию электрона соответствуют три различных квантовых числа:
𝑛 = 2 𝑙 = 0 𝑚 = 0;
𝑛 = 2 𝑙 = 1 𝑚 = 0;
𝑛 = 2 𝑙 = 1 𝑚 = 1;
𝑛 = 2 𝑙 = 1 𝑚 = −1.
Мы получили четыре различных состояния, т. е. число различных состояний на втором энергетическом уровне равно 22. Теперь надо учесть, что в каждом состоянии, определяемом тремя различными квантовыми числами, может быть два электрона с противоположными спинами. Поэтому получается, что на втором энергетическом уровне электронов будет 2∙22=8. Этот результат совпал с уже известным нам числом.
Для оболочки с номером 𝑛 число электронов, очевидно, может быть определено по формуле 2𝑛2.
Знания о квантовых числах помогут нам понять, почему на втором энергетическом уровне может быть два s-электрона и шесть p-электронов. Мы уже знаем, что s-электронами называют такие электроны, для которых значение орбитального квантового числа равно 0; если 𝑙 = 1, то такие электроны называются p-электронами и т. д.
Подсчитаем, сколько электронов с тем или иным значением 𝑙 может быть на одной подоболочке (учтём при этом, что в каждом состоянии движения может быть два электрона с противоположными спинами):
𝑙 = 0 2(2 ∙ 0 + 1) — 2 s-электрона;
𝑙 = 1 2(2 ∙ 1 + 1) — 6 p-электронов;
𝑙 = 2 2(2 ∙ 2 + 1) — 10 d-электронов;
𝑙 = 3 2(2 ∙ 3 + 1) — 14 f-электронов.
Можно ли представить себе электрон? Прежде чем приступить к построению периодической таблицы, я вам перескажу содержание одной беседы. Четверо девятиклассников остались после урока убрать физический кабинет. Разговор шёл об электроне и о том, как они его себе представляют.
— Я не могу представить себе электрон, как представляю какой-либо предмет. Когда я слышу это слово, у меня возникает ощущение какого-то свечения жёлтого цвета.
— А я представляю себе электрон в виде маленького шарика с отрицательным зарядом, который всё время вращается вокруг ядра, как Земля вокруг Солнца.
— Вася, ты не прав! Разве можно сравнить движение электрона и движение планеты вокруг Солнца? Электрон движется вокруг ядра с огромной скоростью — несколько тысяч километров в секунду, поэтому мы не можем указать положение электрона в каждый момент времени, как положение планеты или её спутника. Можешь ты узнать, где находятся шарики центробежного регулятора при большой скорости его вращения?
— Но они же образуют сплошной круг.
— Вот именно. А электрон вокруг ядра вследствие быстрого вращения образует сплошную сферу.
— Вы оба не правы. Какой «маленький» шарик? Электрон надо представлять в виде облака сферической или гантелеобразной формы. Есть облака и других конфигураций, только мы их не изучали.
— Ты знаешь только то, что выучишь. Скажи, электроны какой формы движутся по про-воднику, когда идёт по нему электрический ток. «Сферы» или «гантели»?
Увидев меня, ребята замолчали. Как объяснить им, что ни электрон, ни фотон нельзя вообще представить, потому что они одновременно обладают корпускулярными и волновыми свойствами? В мире, где мы живём, микрообъекты сравнивать не с чем. Поэтому бессмысленно пытаться представлять электрон или какой-нибудь атом. Если мы не можем представить электрон, то как мы можем представить его в движении вокруг ядра?
— Вы слишком громко спорите, значит, не правы.
— Нам хотелось бы знать, как выглядит электрон.
— Это ваше желание не может быть удовлетворено, потому что представить электрон невозможно. Мы можем строить только модели. Вначале было представление об электроне, как частице, и первая модель атома называлась планетарной. Её рисунок вы видели в учебнике физики VII класса. Наверное, поэтому у кого-то из вас и создалось представление, что электрон — «маленький шарик». Позже оказалось, что электрон обладает и свойствами частицы, и свойствами волны. Поэтому его движение отлично от движений тел, которые мы наблюдаем в окружающем нас мире. Например, для него нельзя одновременно с абсолютной точностью, как для планеты, определить скорость и координату. Нельзя указать и точную траекторию. Вместо термина «орбита» в современной атомной физике и химии употребляют термин «орбиталь».
В учебнике химии изображена более поздняя модель атома, у неё вместо орбит орбитали: s-орбитали, p-орбитали. Ничего общего они с формой электрона не имеют. Орбитали дают нам представление только о том, в каких точках пространства вероятнее всего пребывание электрона в каждый данный момент времени. Сказать же точно, где находится данный электрон в данный момент времени в атоме, мы не можем. Не потому, что мы не обладаем для этого необходимыми приборами, а потому, что это невозможно вообще. И представить электрон мы не можем, потому что в нашем мире нет наглядных объектов, с которыми можно было бы его сопоставить.
Построим периодическую систему. Первое место в I периоде системы элементов мы предоставим атому с наименьшим зарядом ядра +1. Это атом водорода. Каждый атом должен быть нейтральной системой, иначе он будет неустойчивым, поэтому у атома водорода должен быть только один электрон. Он займёт место на самом низком уровне, который соответствует главному квантовому числу 𝑛 = 1. Для 𝑛 = 1 число 𝑙 принимает только одно значение 𝑙 = 0. Значит, орбиталь этого электрона в нашем представлении будет иметь форму сферы (s-электрон).
Для заполнения K-оболочки атому водорода не хватает одного электрона. Казалось бы, что водород должен быть очень агрессивным, т. е. захватывать электроны у других атомов. Но для этого у него мало сил — заряд его ядра меньше, чем у ядер других атомов. Поэтому чаще всего атом водорода «жертвует» своим единственным электроном; он охотно соединяется с кислородом, углеродом и атомами других элементов, которые на верхней оболочке имеют более половины электронов, необходимых для завершения внешнего электронного слоя.
Атом следующего в периоде элемента имеет заряд ядра +2, его электронная оболочка вмещает 2 s-электрона, она полностью застроена, т. е. атом «не нуждается» в электронах и поэтому химические реакции, в результате которых можно было бы получить недостающие до заполнения оболочки электроны, его «не интересуют». Гелий – инертный газ. I период закончен.
У атомов II периода будет застраиваться L-оболочка, на ней может поместиться 2𝑛2 = 8 электронов — в этом периоде будет восемь элементов. Начинается период литием, в его атоме на K-оболочке 2 s-электрона, на L-оболочке 1 s-электрон. Энергия связи этого электрона с ядром почти в четыре раза меньше, чем электрона в атоме водорода, поэтому литий легче теряет свой валентный электрон, — это металл. Атом бериллия на s-подуровне L-оболочки имеет 2 s-электрона, энергия их связи с ядром больше, чем у лития, так как на них действует больший заряд ядра, поэтому бериллий менее активный металл, чем литий.
С атома бора начинается заселение p-подуровня L-оболочки. Заряд, действующий на валентные электроны, увеличивается, а значит, увеличивается связь электронов с ядром, поэтому металлические свойства проявляются в меньшей степени. Поскольку на p-подуровне может быть шесть электронов, то заселение его электронами соответствует шести элементам: B, C, N, O, F, Ne. Оканчивается период инертным газом неоном.
Следующий период начинается щелочным металлом натрием и заканчивается инертным газом аргоном, в нём также восемь элементов; у атомов этих элементов застраивается M-оболочка. Элементы III периода по своим свойствам похожи на элементы предыдущей восьмёрки, так как их внешние оболочки одинаковы. Таким образом, можно построить всю периодическую систему. Но построили мы периодическую систему… атомов. Периодическая система элементов глубже и шире периодической системы атомов. Знание физических законов помогает объяснить причины периодичности свойств элементов — они определяются периодичностью застройки внешних оболочек атомов электронами. Но если нам надо определить химические свойства элементов и объяснить их, знаний о строении атомов уже недостаточно.
Согласно квантовомеханическим представлениям об атоме электрон в нём делокализован — его координаты нельзя определить с такой же точностью, как координаты планеты на орбите, они имеют неопределённость порядка атома. При рассмотрении состояния электрона в атоме физики вводят представление об электронном облаке. Форма и эффективные размеры его определяются квантовыми числами 𝑛 и 𝑙 и, значит, меняются при переходе электрона из одного состояния в другое — отождествлять электронное облако с электроном нельзя, тем более невозможно связывать электронное облако с каким-то наглядным представлением об электроне.
Чтобы описать размеры и форму электронного об-лака, вводят некоторую функцию («пси»-функцию, её называют также волновой функцией). Пси-функция даёт возможность определить вероятность обнаружения электрона с данными квантовыми числами в некотором элементе объёма. Но для этого надо решить уравнение Шрёдингера. Решение этого уравнения приводит к строгому выводу последовательности заполнения электронных оболочек и подоболочек атомов, однако пока оно получено только для простейших атомов. Так что фактической теории структуры периодической системы элементов ещё нет. Несмотря на это, квантовая теория позволяет многое понять в периодической системе элементов.
Попробуем ответить на следующие вопросы: почему каждая группа в таблице разделяется на две подгруппы? Почему элементы одной и той же группы, но разных подгрупп так разительно отличаются друг от друга химическими и физическими свойствами? Для определённости выберем какую-нибудь группу, хотя бы четвёртую. Внешние электроны атомов этой группы неодинаковы: у атомов элементов главной подгруппы это 2 s-электрона и 2 p-электрона
одного и того же энергетического уровня (углерод, кремний, германий, олово, свинец); атомы элементов другой подгруппы на внешней оболочке имеют 2 s-электрона одного энергетического уровня и 2 d-электрона предыдущего уровня (титан, цирконий, гафний, резерфордий). Элементы побочной подгруппы — химически стойкие металлы, не поддающиеся коррозии, одинаково ведущие себя в химических реакциях с одними и теми же веществами. Элементы главной подгруппы совершенно не похожи на элементы побочной подгруппы: углерод — неметалл, кремний, германий — неметаллы, олово и свинец — металлы. С увеличением расстояния валентных электронов от ядра металлические свойства элементов начинают проявляться в большей степени. В побочной же группе все элементы — металлы. Как видим, физические и химические свойства элементов определяются как числом валентных электронов их атомов, так и состоянием этих электронов.
Периодичность в природе представлена не только периодическим законом. В природе можно часто наблюдать, что состояние того или иного объекта полностью повторяется через определённые промежутки времени: движение космических тел вокруг центра Галактики, движение планет вокруг центрального светила, движение электронов вокруг ядра, колебание векторов магнитной индукции и электрической напряжённости в электромагнитной волне и др.
В процессе развития также происходит повторение состояния объекта, но оно неполное, это только кажущийся возврат к старому. Примером частной периодичности может служить уже знакомая нам таблица элементов Менделеева. Каждый период начинается более активным металлом, чем предыдущий: натрий более активный металл, чем литий, а калий, которым начинается IV период системы элементов, ещё более активный, чем натрий. В направлении сверху вниз нарастают металлические свойства элементов: в каждом периоде свойства элементов повторяют свойства элементов предыдущего периода, но это неполное повторение.
Вас не удивляет, что рядом с фрагментом таблицы Менделеева иллюстрация к биогенетическому закону? Но ведь мы говорим о неполной повторяемости, а она здесь проявляется: каждая особь в индивидуальном развитии (онтогенезе) повторяет историю развития своего вида (филогенез) — онтогенез есть краткое повторение филогенеза.
Странное чувство охватывает нас, когда мы смотрим на эти рисунки и пытаемся понять законы природы: внутри атома аргона как бы «спрятан» атом неона, а в начале жизни человеческого зародыша — зародыш рыбы или ящерицы… Конечно, человеческий зародыш на определённом этапе только «якобы» зародыш рыбы или ящерицы — это неполное повторение — иначе из него развилась бы рыба или ящерица.
В живой природе можно найти сколько угодно примеров и полной повторяемости, потому что повторяемость, ритм являются формой существования всего живого. В любом организме органы, ткани, клетки работают ритмично. Даже мембраны клеток пропускают ионы в определённом ритме. Нарушение какого-то ритма — признак нарушения жизнедеятельности организма.
Система ритмов в живом организме многоярусна. На нижнем ярусе ритмы клеточные и субклеточные. Из них складываются более сложные ритмы — тканевые, которые служат основой для ритмичной деятельности органов. Ритмично работают органы кровообращения, дыхания, эндокринные железы, нервная система и другие органы. Например, при работе сердца периодически происходит сокращение мускулатуры сердца и её расслабление. Периодичность деятельности сердца отражает его электрокардиограмма.
На рисунке показаны графики, характеризующие изменение энергии ионизации нейтральных атомов в зависимости от порядкового номера элемента и изменение солнечной активности с течением времени.
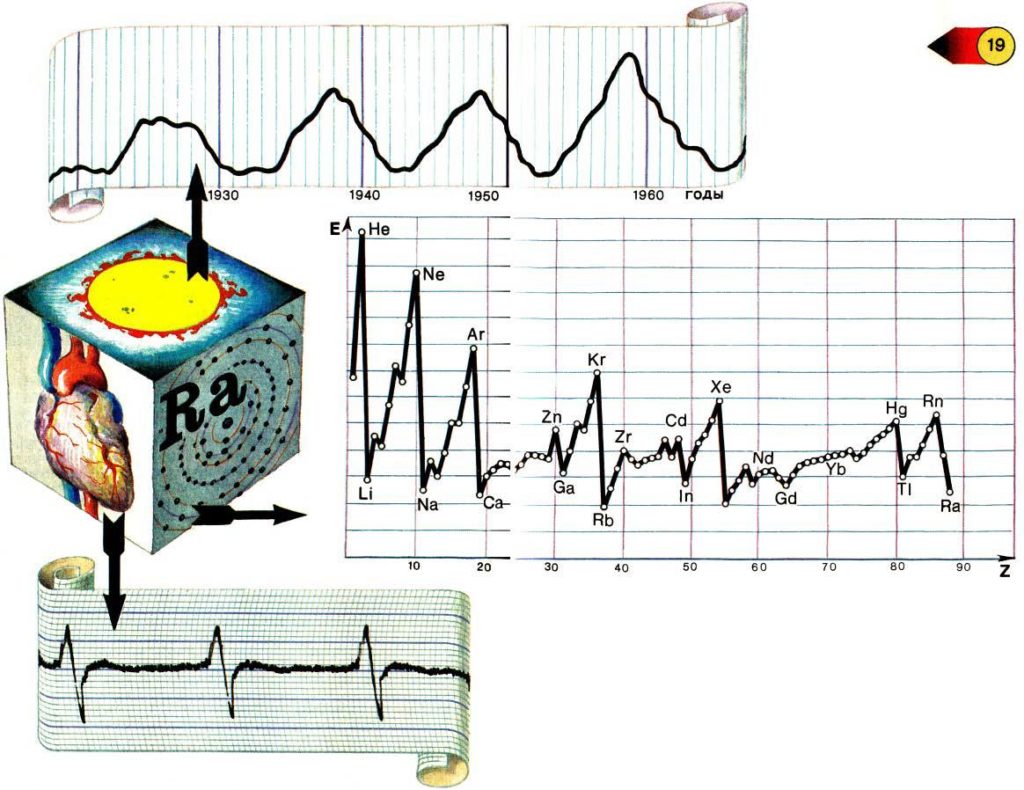
Задумаемся над тем, почему периодичность так распространена в природе, что было бы без неё? Это трудно даже представить себе. Ведь периодичность — условие постоянства структур, функционирования систем. Действительно… Пока электрон периодически движется вокруг ядра, атом остаётся целым (мы не говорим о внутриядерных процессах в атоме); пока Земля периодически движется вокруг Солнца, как и остальные планеты, с Солнечной системой всё «в порядке»; пока в кристалле частицы расположены в определённой очерёдности и на определённом, свойственном для этого кристалла расстоянии, с кристаллом всё «в порядке», пока ровно стучит сердце, с ним всё «в порядке»…
И заметьте, один «порядок» в природе порождает другой. Ведь ритмичная работа органов обусловливает ритмичность деятельности организма в целом, его суточный ритм, а он в свою очередь обусловлен периодическим движением Земли вокруг своей оси. Время нашего сна, бодрствования, принятия пищи, подъёма и спада работоспособности определяется вращением Земли вокруг своей оси.
Каждый организм подчиняется ещё и сезонной периодичности, которая обусловлена движением Земли вокруг Солнца и наклоном оси вращения Земли к плоскости земной орбиты. Так как в различных точках своей орбиты Земля получает разную энергию от Солнца, то протяжённость дня и ночи зависит от положения Земли относительно Солнца. Весна, лето, осень, зима наступают в связи с периодическим движением Земли вокруг Солнца, а именно эти времена года обусловливают различия в жизнедеятельности представителей флоры и фауны на протяжении года.
Период, благоприятствующий развитию живых организмов в нашей географической зоне, продолжается примерно около шести месяцев. Растения бурно развиваются до середины лета. В середине лета, хотя достаточно тепла и осадков, рост растений замедляется или полностью прекращается.
Вторая половина лета — период созревания плодов у растений, накопления в их тканях питательных веществ. Растения готовятся к зиме.
Среди ритмов в природе привлекают внимание геологические, проявляющиеся в масштабах миллионов лет, их называют «волнами жизни». Некоторые учёные считают, что геологические ритмы связаны с космическим влиянием на Землю, в частности с вращением Солнечной системы вокруг центра нашей Галактики и поочерёдным вхождением Земли в области космоса с различной напряжённостью гравитационных полей.
Изучением космических процессов, их влияния на развитие жизни много занимался выдающийся советский учёный А. Л. Чижевский.
Нет возможности здесь рассказать обо всех научных открытиях и исследованиях Чижевского. Достаточно лишь сказать, что он исследовал и установил влияние периодической изменяемости активности Солнца на такие явления, как рост древесины, интенсивность размножения и миграции насекомых, время цветения растений, вековой и годовой ход смертности и др.
Да, если попытаться нарисовать себе общую картину периодических явлений и процессов в природе, то так и хочется вспомнить слова великого Гераклита: «Этот мировой порядок не создан никем из богов и никем из людей, но он был, есть и будет вечно живым огнём, мерами угасающим и мерами вспыхивающим».