
Белки или протеины – высокомолекулярные органические вещества, состоящие из α-аминокислот, соединенных в цепочку пептидной связью:
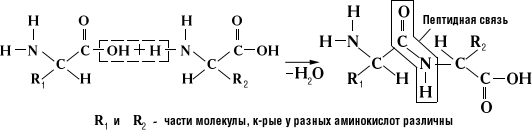
В составе белков человек используются 22 аминокислоты в L-изомерной форме:
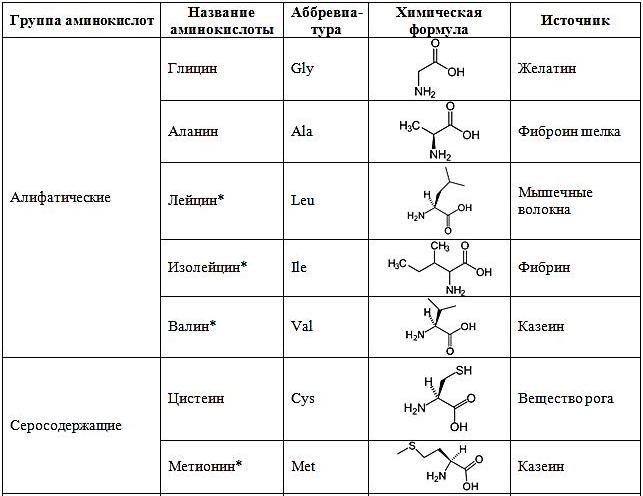
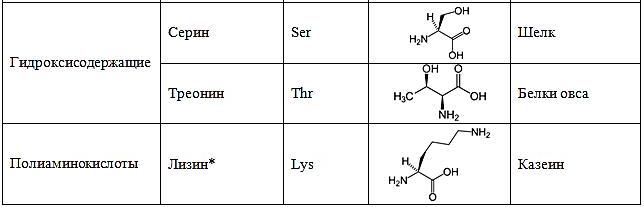

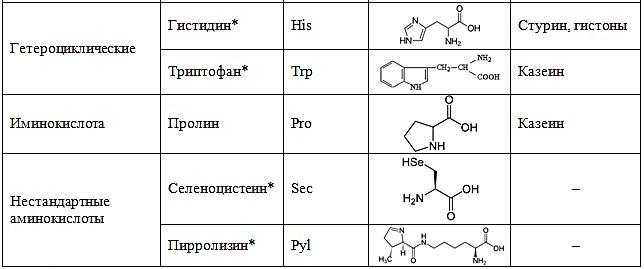
* – незаменимые аминокислоты, т.е. те которые не синтезируются в организме человека и необходимы постоянно.
Классификация белков
Классификация белков по форме молекул:
– фибриллярные (длинные нитевидные молекулы – полипептидные цепи, которые вытянуты вдоль одной оси и скреплены друг с другом поперечными сшивками. Отличаются высокой механической прочностью, нерастворимы в воде, выполняют структурную функцию, образовывают волокна, волосы, коллаген и эластин);
– глобулярные белки (одна и несколько полипептидных цепей свернуты в глобулу, они хорошо растворимы в воде, выполняют регуляторную, транспортную и вспомогательную функцию в виде ферментов, гормонов и т.п.).
Классификация белков по химическому составу:
– металлопротеины (в состав белка входят ионы металлов);
– хромопротеины (в состав входят окрашивающие вещества, например, зрительный белок родопсин и белок крови гемоглобин
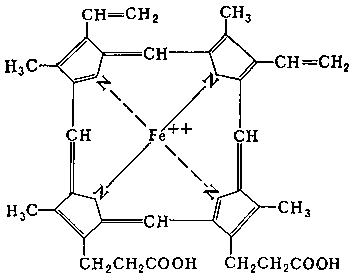
В состав гемоглобина входит гем. В альвеолах легких гемоглобин насыщается О2, а в тканях полученный оксигемоглобин распадается:
Hb + O2 ↔ HbO2
Для заметки, отравление угарным газом происходит из-за образования карбоксигемоглобина:
Hb + СO ↔ HbСO
Белки, содержащие в своем составе молекулу гем, называются гемопротеины);
– фосфопротеины (содержат в составе остатки фосфорной кислоты, связанной с гидроксильной группой аминокислотных остатков сложноэфирной связью).
К фосфопротеинам относят белок молока казеин, содержащий не только остатки Н3РО4, но и Са2+. Многие биопроцессы регулируются посредством фосфорилирования – дефосфорилирования:
Фосфопротеин + Н2 ↔ протеин + Н3РО4
– липопротеины (белки, содержащие ковалентно связанные липиды). Липидный (гидрофобный) компонент удерживающий белок в клеточной мембране. К липопротеинам относят белки крови, участвующие в транспорте жиров.
– гликопротеины (содержащие в качестве простетической группы ковалентно связанный углеводный компонент. Гликопротеины встречаются в секретах (слюне), в клеточной мембране, клеточной стенке, межклеточном веществе, соединительной ткани. Это ферменты и транспортные белки);
– нуклеопротеины (содержащие связанные ДНК и РНК. К ним относят хроматин, из которого состоят хромосомы).
Классификация белков по функциям:
– Структурные белки – коллаген, эластин, кератин, фиброин. Эти белки принимают участие в формировании клеточной мембраны;
– Питательный и запасной белок – казеин, который обогащает организм аминокислотами, фосфором и кальцием; яичный белок и белки семян растения (запасный), который потребляется во время развития зародышей (у человека белок не откладывается);
– Транспортные белки – гемоглобин, переносящий кислород между клетками и тканями, также есть и другие белки, переносящие липиды, глюкозу, аминокислоты, ионы, находящиеся в клеточной мембране;
– Белки-ферменты;
– Защитные белки – иммуноглобулин или антитела, распознающие бактерии, вирусы и чужеродные белки, связывающие с ними и обезвреживающие. Тромбин и фибриноген участвуют в свертывании крови. Фибрин, полученный из фибриногена под действием тромбина, агрегируется, формируя длинные нерастворимые цепи. Гемофилия – снижение свертываемости крови, является заболеванием, связанное с нарушением в структуре генов молекул фибриногена;
– Рецепторные белки – белки, находящиеся на поверхности клеточной мембраны. Сигнальной молекулой часто выступает гормон.
– Регуляторные белки – гормоны (не все), например, инсулин и глюкагон, регулирующий уровень глюкозы в крови, а также гормоны роста и паратиреодный гормон, регулирующий обмен фосфатов и Са2+ в организме.
Аминокислотный скор
Аминокислотный скор (АС) – показатель полноценности белка, который рассчитывается как:
Определенная незаменимая аминоксислота, [мг/г] / Та же аминоксислота в искусственом идеальном белке, [мг/г] × 100 %
Идеальный белок – белок со соотношением незаменимых аминокислот, позволяющее организму без проблем обновлять внутренние структуры.
Если по каждой незаменимой аминокислоте аминокислотный скор будет более 100 %, то такой белок признается полноценным.
Аминокислота, по которой идет расчет и при этом аминокислотный скор будет менее 100 %, является лимитирующей, а сам белок ее содержащую – неполноценным. Так бобовые имеют лимитирующую аминокислоту метионин (АС 59 %), следовательно, надо дополнять рацион питания либо белком природного происхождения, либо растительными продуктами, в которых метионина достаточно. Также в злаковых лимитирует лизин (АС 56 %), в перловой крупе – треонин (АС 62 %), в пшене – лизин (АС 49 %) и валин (АС 79 %), в коровьем молоке – метионин + цистеин (АС 78 %) и триптофан (АС 82 %).
Пищевая ценность белка
Биологическая (пищевая) ценность белка определяется сбалансированностью аминокислотного состава по содержанию незаменимых аминокислот, а также это степень задержки азота пищи в теле растущего организма или эффективной его утилизации для поддержания азотистого равновесия у взрослых.
Белки животного происхождения являются полноценными, растительного происхождения – нет.
Биологическая ценность белка также определяется по степени его усвояемости:
Рыба > Молочные продукты > Мясо > Хлеб > Крупы
У круп низкая усвояемость белка из – за связи растительных белков с полисахаридами, которые затрудняют доступ пищевых ферментов к полипептидам.
Суточная потребность взрослого среднестатистического человека в белках составляет максимум 1,5 г на кг массы тела (70 – 100 г белка в сутки), из которых 55 % должны составлять белки животного происхождения и 45 % – растительного.
Превращение белков при переработке и хранения пищи
- Денатурация – нарушение уникальной конформации (вторичной, третичной, четвертичной структуры) нативного белка с сохранением его первичной структуры.
Факторы денатурации:
Физические:
– нагрев;
– механическое перемешивание;
– ультразвук;
– УФ и ионизирующее излучение.
Химические:
– воздействие кислот;
– воздействие щелочей;
– воздействие солей тяжелых металлов;
– воздействие мочевины;
– воздействие органических растворителей.
- Декструкция – тепловая обработка белка (термолиз) при Т ≈ 100-120 °С, приводящая к разрушению макромолекул белка (первичная структура).
- Гидролиз – разрушение первичной структуры белка под действием H2O.
- Термическая обработка белков выше 200 °С или при более низкой температуре в щелочной среде вызывает реакцию изомеризации остатков аминокислот из L- в D-форму (так уменьшает усвояемость белков).
- В сильнощелочной среде при повышенной температуре может протекать реакция конденсации остатков аргинина, гистидина, треонина, серина, тирозина, триптофана.
- При Т ≈ 40-100 °С протекает взаимодействие белков с восстанавливающими сахарами, сопровождающееся образованием карбоксильных соединений и темноокрашенных продуктов – меланоидинов (по реакции Майяра или реакция меланоидинообразования):
Примером реакции меланоидинообразования является потемнение корочки хлеба при выпекании. При реакции уменьшается пищевая ценность продукта.
- Неблагоприятные погодные условия при созревании зерна, поражение его вредителями и микрофлорой, понижение или повышение температуры при хранении и переработке сырья и полуфабрикатов, механические, физические и химические факторы усиливают структурную перестройку белков, которые могут разрушать природные белково-липидные взаимодействия. Высвобождающиеся липиды, подвергаясь окислительной порче, способны инициировать образование ковалентных меж- и внутримолекулярных связей в белках и новых полимерах. Все реакции окисления связаны с потерей незаменимых аминокислот. Окислительная порча белков опасна при хранении и переработке масличного и жирового сырья.